基于海藻酸钠微粒稳定的Pickering乳液增强界面生物催化

背景介绍
随着生物科学的发展,酶在食品中的用途越来越广泛,例如食品保鲜、改善食品品质和风味等。然而酶通常只在水相中表现出活性,而有机底物在水中很难溶解,因此酶的双相生物催化成为研究的热点。其中将酶固定在固体颗粒上进而稳定Pickering乳液是提高酶的稳定性和催化效率的有效方法。该法不仅可以扩大水相酶与有机相底物的接触面积、缩短底物分子的扩散距离,而且可以实现酶和固体颗粒的循环利用。目前常见的是经化学法将酶共价吸附在介孔二氧化硅颗粒、碳质微球、石墨烯纳米片等固体颗粒上,然而该固定化酶在重复使用后会发生变性降低其催化活性。本研究使用易于凝胶化的海藻酸钠(Na-Alg)作为固定脂肪酶的载体,并以硅烷化二氧化钛纳米粒子为包封层改善了颗粒的亲疏水性,稳定了用于双相高效生物催化的W/O型Pickering乳液。
研究方法
本研究分别使用硅烷接枝的二氧化钛(s-TiO2)纳米颗粒和Span 80稳定W/O型乳液,前者添加氯化钙,后者添加Na-Alg和脂肪酶,再将两者混合。氯化钙可以提高Alg的凝胶强度,将脂肪酶固定在Alg上,制备带有s-TiO2层的固定化酶—E@Alg@s-TiO2微粒,并通过改变接枝硅烷的链长,改善微粒的润湿性稳定双相高效生物催化W/O型Pickering乳液。
结果与分析
1)扫描电镜观察Alg@s-TiO2微粒的微观形态并使用EDS对其进行元素分析。图1(a)-(c)显示Alg@s-TiO2微粒由含6个碳原子的硅烷偶联剂(Alg@C6-TiO2)和纯Alg组成,几乎所有的Alg微粒均为直径2-5μm的规则球形颗粒,与之相比Alg@C6-TiO2微粒(图1(a)、(b))由于C6-TiO2的覆盖表面更粗糙,形状更为不规则。EDS结果显示(图1(c))钛原子存在于Alg@C6-TiO2微粒表面,在乳液凝胶化过程中,带正电的C6-TiO2可以覆盖在带负电的Ca-Alg微球表面。使用异硫氰酸酯荧光染色剂(FITC)标记脂肪酶(图1(d)),蓝色荧光染料标记C6-TiO2(图1(e)),激光共聚焦显微镜(CLSM)观察结果显示脂肪酶被成功的固定在Alg微粒中,形成E@Alg@C6-TiO2微粒。正己烷作为油相,分别用FITC和尼罗红分别对水相和油相进行染色,CLSM观察显示(图1(g)-(i))E@Alg@C6-TiO2成功稳定了W/O型Pickering乳液,液滴平均直径为250μm。
2)探究了s-TiO2和E@Alg@s-TiO2微粒表面润湿性的影响因素。随着硅烷链从6增加到10,s-TiO2纳米颗粒的三相接触角从110°增加到130°(图2(a1)-(c1)),同样的E@Alg@s-TiO2微粒的三相接触角从100°增加到130°(图2(d1)-(f1))。这是由于随着硅烷链的增加,颗粒的疏水性增强。实验发现s-TiO2纳米颗粒和E@Alg@s-TiO2微粒均可以稳定正己烷为油相的W/O型Pickering乳液,但是随着硅烷链的增加可稳定的水相体积减小(图2(a2)-(f2)),乳液液滴增大(图2(a3)-(f3)),乳液稳定性降低。
3)使用浓度为2%的E@Alg@C6-TiO2微粒稳定W/O型Pickering乳液并使用光学显微镜观察乳液(图3(a)、(b)),微粒在正己烷和水界面分布较密集。通过1-己醇和己酸的酯化反应探究了W/O型Pickering乳液催化体系的催化性能。实验中建立了三种催化体系:一是脂肪酶分散于水-己烷界面;二是脂肪酶分散在Alg@C6-TiO2微粒稳定乳液的水相中;三是将脂肪酶固定在Alg@C6-TiO2微粒中。三种催化体系的反应条件相同,结果发现在反应前四个小时,后两种催化体系转化率均可达到85%-95%,其中第三种催化体系的转化率高于第二种;第一种催化体系的转化率仅为20%(图3(c))。这归因于E@Alg@C6-TiO2微粒稳定W/O型Pickering乳液使得界面面积大幅增加,增大了酶与底物的接触面积。图3(d)显示第三种催化体系的脂肪酶催化活性比第一种催化体系的催化活性高11倍。这是因为在E@Alg@C6-TiO2微粒稳定W/O型Pickering乳液中,所有微粒均吸附在界面上,脂肪酶不仅有Ca-Alg保护,而且由于乳液液滴减小极大的减小了底物的扩散距离,使得酶与底物接触的可能性增大,催化效率提高。
4)E@Alg@C6-TiO2微粒稳定W/O型Pickering乳液体系催化1-己醇和己酸的酯化反应重复进行10个循环,并利用重力沉降作用将产物和反应物进行分离,同时E@Alg@C6-TiO2微粒也易于回收。脂肪酶在该催化体系循环利用10次后仍能保持91%的比活性,这得益于Ca-Alg和TiO2壳层的保护,轻微的酶活下降可能是由于脂肪酶的变性。

图1 Alg@s-TiO2微粒的SEM图像(图1(a))、Alg@s-TiO2微粒的SEM放大图像(图1(b))、EDS元素分析(图1(c));FITC标记脂肪酶、蓝色荧光染料标记C6-TiO2 CLSM观察图像(图1(d)-(e));FITC和尼罗红分别对水相和油相进行染色乳液CLSM观察图像

图2 不同硅烷链长的s-TiO2和E@Alg@s-TiO2微粒的三相接触角(图2(a1)-(f1));不同硅烷链长的s-TiO2和E@Alg@s-TiO2微粒稳定的W/O型Pickering乳液(图2(a2)-(f2));不同硅烷链长的s-TiO2和E@Alg@s-TiO2微粒稳定的W/O型Pickering乳液的乳液液滴图像(图2(a3)-(f3))
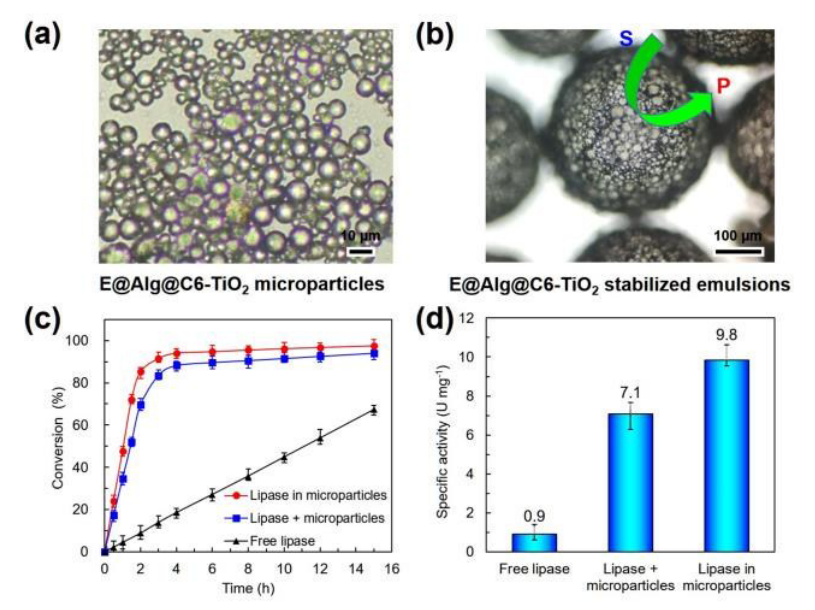
图3 乳液光学显微镜图片(图3(a)、(b));催化体系的转化率(图3(c));催化体脂肪酶的催化活性(图3(d))

图4 脂肪酶的重复次数和比活性
结论
此项研究中,利用E@Alg@s-TiO2微粒稳定W/O型Pickering乳液,并催化1-己醇和己酸的酯化。在该体系中脂肪酶的催化活性是游离脂肪酶的催化活性的11倍,反应进行4h时转化率达到了85-95%,远高于游离脂肪酶同时间的转化率20%,极大的提高了脂肪酶活性,同时还实现了脂肪酶和固体颗粒的重复利用,并且在循环利用10次后相对活性仍可保持91%。
原文链接
https://pubs.rsc.org/en/content/articlelanding/2019/gc/c8gc03573c
供稿人:
李薇



